Gerenciamento do Ciclo de Vida do Produto Farmacêutico: As Bases Fundamentais do ICH
No complexo universo da indústria farmacêutica, a qualidade e a segurança dos produtos não são apenas exigências legais, mas também compromissos éticos com a saúde pública. Para assegurar que cada medicamento que chega ao mercado atenda aos mais altos padrões, o gerenciamento do ciclo de vida do produto farmacêutico é crucial. E é aqui que […]
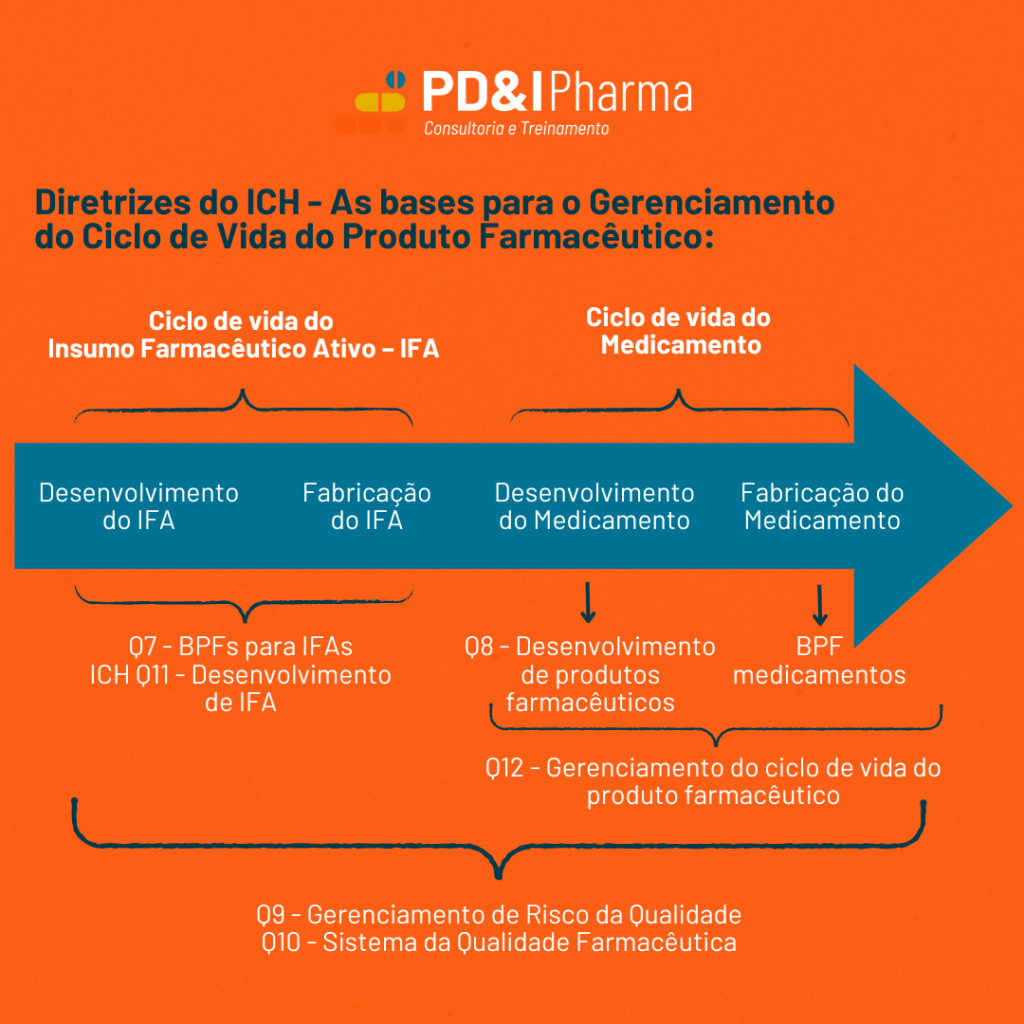
No complexo universo da indústria farmacêutica, a qualidade e a segurança dos produtos não são apenas exigências legais, mas também compromissos éticos com a saúde pública. Para assegurar que cada medicamento que chega ao mercado atenda aos mais altos padrões, o gerenciamento do ciclo de vida do produto farmacêutico é crucial. E é aqui que as diretrizes do International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) desempenham um papel fundamental.
O que é o Ciclo de Vida do Produto Farmacêutico?
O ciclo de vida do produto farmacêutico abrange todas as etapas desde o desenvolvimento do Insumo Farmacêutico Ativo (IFA) até a fabricação do medicamento final. Cada uma dessas fases tem sua importância e deve ser rigorosamente controlada para garantir que o produto final seja seguro e eficaz.
- Desenvolvimento do IFA: O IFA é o coração de qualquer medicamento, sendo o componente responsável pelo efeito terapêutico. O desenvolvimento do IFA é a primeira etapa e, nesta fase, são seguidas as diretrizes estabelecidas no ICH Q7 (Boas Práticas de Fabricação – BPFs) e no ICH Q11 (Desenvolvimento do IFA).
- Fabricação do IFA: Após o desenvolvimento, o próximo passo é a produção do IFA em larga escala. Este processo precisa seguir rigorosamente as normas estabelecidas para garantir que o IFA mantenha a qualidade, pureza e potência esperadas.
- Desenvolvimento do Medicamento: Com o IFA em mãos, inicia-se o desenvolvimento do medicamento final. Este processo envolve a formulação do produto, testes clínicos e ajustes para garantir que o medicamento seja seguro para uso humano. As diretrizes do ICH Q8 orientam essa fase, focando no desenvolvimento de produtos farmacêuticos robustos e de alta qualidade.
- Fabricação do Medicamento: A fabricação do medicamento é a última etapa do ciclo de vida. Aqui, a aplicação das Boas Práticas de Fabricação (BPFs) é essencial para garantir que cada lote produzido atenda aos padrões de qualidade e segurança estabelecidos.
Gerenciamento e Controle da Qualidade
Além das etapas de desenvolvimento e fabricação, é fundamental gerenciar os riscos e manter um sistema de qualidade robusto ao longo de todo o ciclo de vida do produto. As diretrizes ICH Q9 e Q10 são centrais para o gerenciamento do risco da qualidade e para a implementação de um sistema de qualidade farmacêutica eficiente, respectivamente. Elas garantem que todos os processos sejam monitorados e que quaisquer desvios possam ser rapidamente identificados e corrigidos.
Gerenciamento do Ciclo de Vida
O ICH Q12, que trata do gerenciamento do ciclo de vida do produto farmacêutico, integra todas essas etapas em um sistema coeso. Essa diretriz permite que as indústrias farmacêuticas mantenham a qualidade e a conformidade dos seus produtos, mesmo após a sua introdução no mercado, ajustando processos e melhorando continuamente a produção.
Conclusão
O gerenciamento do ciclo de vida do produto farmacêutico, guiado pelas diretrizes do ICH, é uma abordagem estruturada e essencial para garantir que os medicamentos sejam desenvolvidos, fabricados e mantidos com a máxima qualidade e segurança. Para a PD&I Pharma, entender e implementar essas diretrizes não é apenas uma exigência regulatória, mas uma parte fundamental do compromisso com a saúde e o bem-estar dos pacientes.
Por meio dessa abordagem, a PD&I Pharma assegura que cada medicamento produzido seja seguro, eficaz e da mais alta qualidade, cumprindo com as expectativas dos profissionais de saúde e dos pacientes ao redor do mundo.